摇卦免费华海药业生产基地再收警告信 公司称不会对当期业绩产生重大影响
界面新闻记(🔗)者 | 黄华
摇卦免费 界面新闻编辑 | 谢欣
摇卦免费 6月(🧣)9日,华海药业公告其收到美国食品药品监督管理局(简称“FDA”)的警告信,该警告信系基于今年1月16日至1月24日期间,前述部门对公司位于临海市汛桥镇的药品生产基地(下称“汛桥生产基地”(🛅))进行的现场检查。
华海药业的公告显示,警告信主要涉及部分口服固体生产设备清洁管理、无菌生产区域维护和压片剔废参数研究的充分性,公司重视美国食品药品监督管理局建议,已积极采取措施进行优化,并持续与其保持积极沟通。
对于前述事件,华海药业在6月(🉐)10日接受界面新闻记者采访时表示,目前以公告内容为主。
(📺) 对于后续影响,华海药(🥂)业在回复界面新闻记者时表示,本(🌦)次警告信仅对涉及汛桥生产基地的仿制(🔹)药上市许可申请(ANDA新申请)(🚰)或补充申请的批准产生影响,不会对公司当期业绩产生重大影响。
摇卦免费 二级市场上,6月10日,华海药(🚙)业股价并未受影响。截至收盘,该公司报21.17元/股(⛲),涨7.41%,总市值319.22亿元。

华海药业现阶段已发(🐧)展为国内大型仿制药企,也是国内药品制剂向美出海的龙头公司。该公司2024年度年报显示(🙂),在接近95亿元的年收入中,美国制剂业务销售收入约13亿元,占比超10%。
界面新闻记者注意到,美国食品药品监督管理局官网当前公(🕯)开了一份记录日期为今(✖)年4月16日的483表格(📰)(注:483表格为美国食品药品监督管理局(🗜)现场观察报告,内会记录检查发现的不合规信息或缺(🔈)陷),其中的检查日期与地点与华海药业6月9日公告中(🔒)披露的信息相一致(附图如下)。
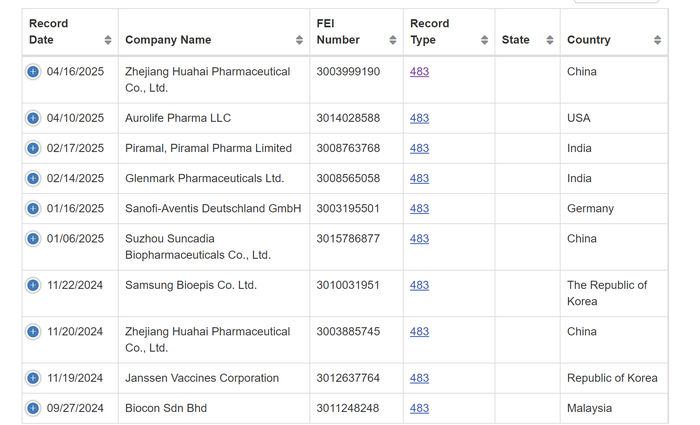
摇卦免费 据前述438表格,美国食品药品监督管理局的检查员认为,该设备和器具未按适当(🍆)的时间间隔进行清洁,它有可能改变药品的安全、身份、强度、质量或纯度;声称无菌(⏰)的药品受微生物污染规程缺乏充分验证;缺乏书面程序用于生产和过程控制,以确保药物产品具有它们声称或声称具有的标识、强度质量和纯度,等等。

6月10日,上海某具有多年药品生产质量管理规范经验的人员在(🗽)接受界面新闻记者(🏟)采访时表示,一般而言,列在美国食品药品监督管理局FDA-483表上的缺陷均属(📽)于显著的(🍬)药品生产质量管理规范(cGMP)问题;比如,药品生产质量管理规范首要目的(🙆)为“防污染、交叉污染”,而该公司被查出的诸多设备清洁问题就意(👆)味着企业在“防污染、交叉污染”管控方面明显不足。
摇卦免费(🏾) 前述人员向界面新闻记者提出,美国食品药品监督管理局开483表的原则为:最严重的缺陷列在最前面,所以第1条观察项(Observation)也是该次现场检查中最严重的缺陷。其认为,这些设备清洁相关(🎿)的问题也影响已销售的产品批次,企业需评估在(💥)日常生产中是(🌇)否也存在相似问题(🚇),有哪些潜在交叉污染风险。
摇卦免费 在过去,华海药业也收到警告信,暴露了生产体(📳)系中(🕶)存在的风险。其中,最严重的事件莫过于缬沙坦(🔩)杂质事件。据华海药业2019年初(💒)公告,缬沙坦杂质事件发生后,美国食品药品监督管理局对公司进行了现场检查并对公司川南生产基地出具进口禁令及警告信。
后在2021年11月,华海药业收到警告信关闭函,意味着该公司已解决警告信中提及的相关问题。不过,这一事件对华海药业有持续影响。
摇卦免费 据企业2024年度年报,华海药业受缬沙坦杂质事件影(🗽)响,对缬沙坦产品市场召回费用和可能承担因缬沙坦原料药杂质问题及相关产品断供等给客户造成的损失补偿进行了预计,这笔费用约1.5亿元。
摇卦免费 企业2024年度年报也显示,受缬沙坦杂质事件影响,截至资产负债表日,华海药业尚存在与山德士的未决仲裁,仲裁事项仍在推进过程中。
相关链接:
- 理想同学接入 DeepSeek-R1-0528 最新模型
- 门店 239 元 → 官方 23 元:森马男女休闲短裤 1~2 折清仓再发车
- 乒超神仙打架累坏国手,樊振东七战全胜实力依旧
- 中国商务部回应稀土出口管制:国际通行做法
- 东方电气新董事长到位,由国机集团原总经理罗乾宜出任
- 成本乱象与虚假宣传夹击 建盏产业如何破局?
- 何立峰:中国坚定不移推进高水平对外开放,欢迎美资金融机构积极参与中国资本市场建设发展
- 阿斯加特推出基于长鑫存储 DDR5 国产颗粒“海姆达尔 x 耀”内存条,32G 套条 559 元
- 联想极光游戏服务方案解析:以极光 GK10 键盘开启软硬一体智能体验革命
- 小米 Watch S4 eSIM 15 周年纪念版发布:搭载自研玄戒 T1 芯片,售 1299 元
相关新闻
- 摇卦免费中非新增10对友好城市 国际“朋友圈”助推务实合作详细阅读

中新社长沙6月13日电 (刘曼)非洲国家投资推介暨中非农业产贸合作对接活动13日在湖南长沙举行,9对中非友好城市现场签约“结好”。加上此前在长沙签...
2025-06-1652
- 摇卦免费我国新增10家国家考古遗址公园详细阅读

中新网6月14日电 据国家文物局微信公众号14日消息,国家文物局近日发布《国家文物局关于公布10家国家考古遗址公园名单的通知》,10家单位列入国家...
2025-06-1662
- 摇卦免费“科创板八条”一周年,艾力斯、百利天恒、晶合集成等多位科创板公司掌门人发声!详细阅读

《关于深化科创板改革服务科技创新和新质生产力发展的八条措施》(以下简称“科创板八条”)发布即将满一周年。一年来,“科创板八条”相关举措绝大部分已完...
2025-06-1672
- 摇卦免费伊朗“报复性”空袭以色列致数十人伤亡 以持续打击伊机场、核设施等详细阅读

中新社北京6月14日电 综合消息:伊朗13日晚开始对以色列发动“报复性”导弹袭击。据以色列媒体14日报道,袭击造成以至少2人死亡、70人受伤。伊朗...
2025-06-1681
- 摇卦免费远东宏信:合共2090.5万美元的债券已于6月13日转换并注销详细阅读
远东宏信(03360)发布公告,自2025年6月7日至本公告日期,本金总额合共2090.5万美元的债券(佔债券初始本金总额约6.97%)已于20...
2025-06-1683
- 摇卦免费台风“蝴蝶”将登陆华南 国家防总办公室、应急管理部持续调度部署防范应对工作详细阅读

中新网6月13日电 据应急管理部网站消息,6月13日,国家防总办公室、应急管理部组织自然资源部、交通运输部、水利部、农业农村部、中国气象局等部门联...
2025-06-1592
- 摇卦免费【图解牛熊股】稀土概念股涨幅居前,油气开采板块表现强势详细阅读

来源:@财联社APP微博财联社6月15日讯,本周A股三大指数涨跌不一,其中上证指数周跌0.25%,深成指跌0.6%,创业板指涨0.21%。板块方面,...
2025-06-1599
- 摇卦免费以色列与伊朗冲突升级 埃及领跌中东股市详细阅读
周日,多数中东市场下跌,因以色列与伊朗的报复性攻击引发投资者对冲突扩大的担忧加剧。 自上周五冲突爆发以来,埃及主要股指在首个交易日成为表现最差...
2025-06-15105
